今日から高校化学について勉強したいと思います。
ちなみに、1年だとか3年のレベルとかは気にしないで進めます。
なぜなら、受験ではどのみち必要だからです。
心して勉強してゆきましょう!
講義
1. 単体・化合物・混合物とは?
物質にはいくつかの種類があります。まず「単体(たんたい)」というのは、ひとつの元素からできている物質のことです。例えば、酸素(O₂)や鉄(Fe)は単体です。それに対して、「化合物(かごうぶつ)」は、2種類以上の元素が化学的に結びついてできた物質です。例えば、水(H₂O)は水素(H)と酸素(O)が結びついてできた化合物です。そして、「混合物(こんごうぶつ)」というのは、いくつかの物質が物理的に混ざり合っているものです。例えば、海水は水と塩が混ざってできていますが、化学的に結びついているわけではありません。
2. 同素体とは?
同じ元素でできているのに、性質や構造が違う物質を「同素体(どうそたい)」と言います。たとえば、炭素(C)は同じ炭素原子からできていますが、ダイヤモンドと黒鉛(グラファイト)という2つの異なる形を持つことができます。これらは同じ元素なのに全く違った性質を持っています。
3. 原子の構造について
すべての物質は「原子(げんし)」からできています。原子はとても小さく、目には見えませんが、実は内部に「原子核(げんしかく)」と「電子(でんし)」があります。原子核は原子の中心にあって、その中に「陽子(ようし)」と「中性子(ちゅうせいし)」という粒子が入っています。陽子はプラスの電気を持ち、中性子は電気を持っていません。そして、電子はマイナスの電気を持っていて、原子核の周りをぐるぐる回っています。
4. 原子核とその中身
原子核は原子の「心臓」と言える部分です。ここに陽子と中性子が集まっています。陽子は正の電荷を持つので、同じ陽子同士は反発し合うはずですが、中性子がそのバランスを保って原子核が崩れないようにしているんです。この組み合わせが原子の安定性を保つ鍵となります。
5. 電子の役割
電子は原子の周りを取り囲むように動いています。電子がどのように配置されているかで、物質がどんな性質を持つかが決まります。例えば、化学反応が起こるときは、この電子が他の原子と結びついたり、離れたりします。
電子配置とイオン
1. 電子配置とは?
原子の中の電子は、好きな場所に適当にいるわけではなく、ちゃんとしたルールに従って並んでいます。この並び方を「電子配置(でんしはいち)」と言います。電子は原子核の周りをぐるぐる回っていますが、実は「層(そう)」のような場所に分かれているんです。この層を「電子殻(でんしかく)」と言います。
例えば、水素(H)の原子は電子が1個しかないので、最も内側の電子殻にその1個が入ります。ヘリウム(He)は電子が2個ありますが、この2個も最も内側の層に収まります。
電子殻には収容できる電子の数が決まっていて、内側から順番に埋められていきます。
例えば:
- 最初の層(K殻)には最大で2個の電子が入れます。
- 次の層(L殻)には最大8個の電子が入ります。
このようにして、電子がどのように並んでいるかによって、物質の性質が変わってきます。
2. 電子配置と化学反応
物質同士が反応するとき、特に重要なのが一番外側の電子の層です。この一番外側にある電子を「最外殻電子(さいがいかくでんし)」と言います。原子はこの最外殻電子を使って、他の原子とくっついたり、離れたりします。最外殻が満杯になると、その原子はとても安定になります。だから、他の原子と電子をやりとりして最外殻を満たそうとするんです。これが化学反応の基本です。
3. イオンとは?
「イオン」というのは、原子が電子を失ったり、逆に受け取ったりして電気的な性質を持つようになった状態のことです。普通の原子は電気的に中性ですが、電子のやり取りが行われると、電荷のバランスが崩れます。
- 陽イオン(ようイオン):原子が電子を失うと、正の電荷を持つようになります。この状態を「陽イオン」と呼びます。たとえば、ナトリウム(Na)の原子は1個の電子を失って、Na⁺ という陽イオンになります。
- 陰イオン(いんイオン):逆に、原子が電子を受け取ると、負の電荷を持ちます。この状態を「陰イオン」と呼びます。例えば、塩素(Cl)の原子は1個の電子を受け取って、Cl⁻ という陰イオンになります。
イオンは、正と負の電気を持っているので、陽イオンと陰イオンはお互いに引きつけ合います。これが「イオン結合(イオンけつごう)」というものです。ナトリウムイオン(Na⁺)と塩化物イオン(Cl⁻)が結びつくと、食塩(NaCl)という化合物ができるわけです。
確認問題
問題1: 単体・化合物・混合物
以下の物質について、あと5つの問いに答えなさい。
- 水素
- 塩化ナトリウム
- 酸素
- 空気
- ダイヤモンド
- オゾン
- 塩酸
- 二酸化炭素
- 黒鉛
- アンモニア
(1) 混合物を2つ選び、記号で答えよ。
解答: 空気、塩酸
解説: 混合物は、異なる物質が物理的に混じり合ったもので、化学的に結合していないものです。空気と塩酸は、複数の物質が混じり合っているため、混合物に該当します。
(2) 酸素を含む化合物を1つ選び、記号で答えよ。
解答: 二酸化炭素
解説: 化合物は、複数の元素が化学的に結合している物質です。二酸化炭素は、炭素と酸素からなる化合物です。
(3) 互いに同素体の関係にあるものは、どれか。2組選び、記号で答えよ。
解答: ダイヤモンドと黒鉛; 酸素とオゾン
解説: 同素体とは、同じ元素から成り立つが、異なる構造を持つ物質です。ダイヤモンドと黒鉛は炭素から成り立ち、酸素とオゾンは酸素元素から成り立っていますが、それぞれ異なる構造を持っています。
(4) クとキが混合しているとき、これらを分離するのに最も適した操作は、次のうちのどれか。1つ選び、記号で答えよ。
解答: (a) 蒸留
解説: ク(二酸化炭素)とキ(塩酸)を分離するには、塩酸中の水を蒸発させる蒸留が適しています。
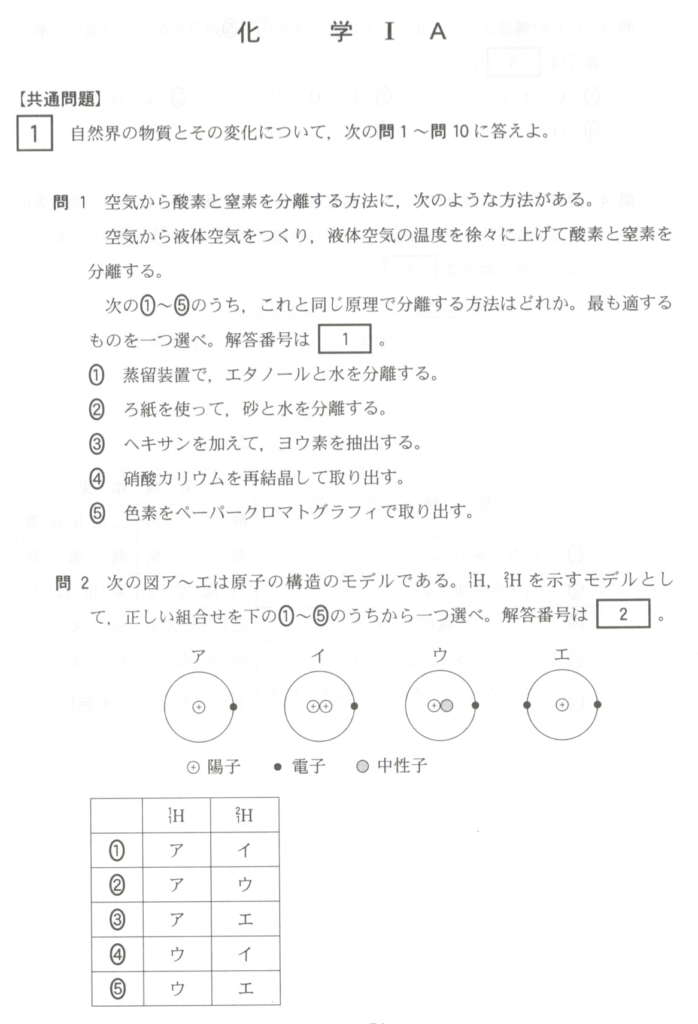
問題2: 原子の構造
天然の水素原子には、1Hと2Hが、酸素原子には、16Oと17Oと18Oが存在します。これについて、以下の問いに答えましょう。
(1) 1Hと2H、および16Oと17Oの関係を、互いに何というか。
解答: 同位体
解説: 同位体は、同じ元素でありながら、中性子の数が異なるため、質量が異なる原子のことを指します。
(2) 16Oの原子1個あたりの電子の数、原子核中の陽子の数、および中性子の数は、それぞれいくらか。
解答: 電子数: 8, 陽子数: 8, 中性子数: 8
解説: 酸素原子(16O)は、原子番号が8なので、陽子の数と電子の数は8です。質量数16から陽子の数8を引くと、中性子の数は8となります。
(3) 天然の水分子には、何種類のものがあるか。
解答: 3種類
解説: 水分子は、1H2O, 1H2O, 2H2Oの3種類の同位体組み合わせで存在します。
問題3: 原子の電子配置と周期表
次の( )内の原子番号をもつ元素A~Gについて、以下の問いに答えよ。
(1) 希ガスはどれか。
解答: G(16)
解説: 原子番号16の元素は希ガス(硫黄)です。希ガスは、化学的に安定し、反応しにくい特徴があります。
(2) 周期表17族に属する元素はどれか。
解答: E(15)
解説: 原子番号15の元素(リン)は、周期表の17族に属します。17族元素はハロゲンとも呼ばれ、反応性が高い特徴があります。
(3) 互いに同族の元素はどれとどれか。
解答: C(10)とD(12)
解説: C(ネオン)とD(マグネシウム)は同じ族に属しており、化学的性質が似ています。
(4) 6個の価電子をもつ元素はどれか。
解答: F(15)
解説: 原子番号15の元素(リン)は、外殻に6個の価電子を持っています。価電子は、化学結合を形成するために関与する電子です。
問題4: 電子配置とイオン
次の( )内の原子について、以下の問いに答えよ。
- ① Na
- ② Mg
- ③ Al
- ④ Cl
- ⑤ Ar
(1) 2価の陽イオンに成りやすい原子はどれか。そのイオンは何個の電子をもつか。
解答: ② Mg; イオン電子数: 10
解説: Mgは、2価の陽イオンMg²⁺になりやすく、電子を2個失うので、電子数は10になります。
(2) 1価の陰イオンに成りやすい原子はどれか。そのイオンは何個の電子をもつか。
解答: ④ Cl; イオン電子数: 18
解説: Clは、1価の陰イオンCl⁻になりやすく、電子を1個得るので、電子数は18になります。
(3) イオン化エネルギーが最も小さい原子はどれか。
解答: ① Na
解説: イオン化エネルギーは、電子を取り除くために必要なエネルギーです。Naは、1価の陽イオンになりやすく、イオン化エネルギーが小さい特徴があります。
(4) 電子親和力が最も大きい原子はどれか。
解答: ④ Cl
解説: 電子親和力は、原子が電子を受け入れる際に放出されるエネルギーです。Clは、電子を受け入れやすく、電子親和力が大きい特徴があります。
(5) Ar, Cl, Na, Mg, Alの順に並べると化合物の化学式と名称をそれぞれ記述せよ。
解答:
- NaCl (塩化ナトリウム)
- MgCl2 (塩化マグネシウム)
- AlCl3 (塩化アルミニウム)
解説: Na, Mg, AlはそれぞれClと結合し、対応する化合物を形成します。
応用問題
では、ここから実際の入試問題をやってみたいと思います。
いきなり入試問題!?
と思う人もいるかもしれませんが、皆さんの1番の目的は入学試験をパスすることです。
早いうちから慣れていきましょう。
ちなみに、以下の問題は大検と言われるもので、今は別の名前になったのですが、当時大学入学資格検定というものがあり、その入試の一部を引用させてもらいました。
大検は正直簡単な問題で、3ヶ月勉強すればパスできる内容です。
なので、サクッといきましょう。